卵管内の受精卵へのエレクトロポレーションによるゲノム編集(i-GONAD法)
アプリケーション
rGONAD法によるゲノム編集ラットの作製
rGONAD法におけるエレクトロポレーションの条件の最適化
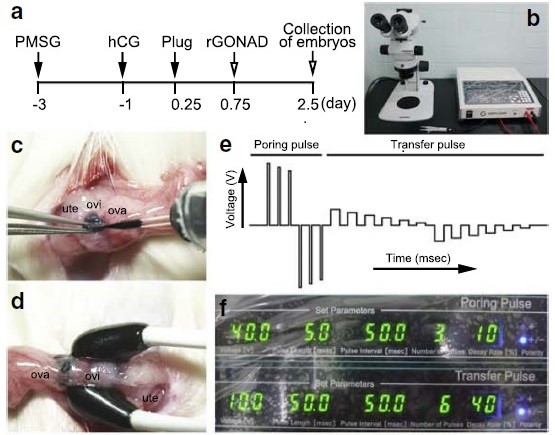
- GONAD法におけるエレクトロポレーション効率評価の実験手順
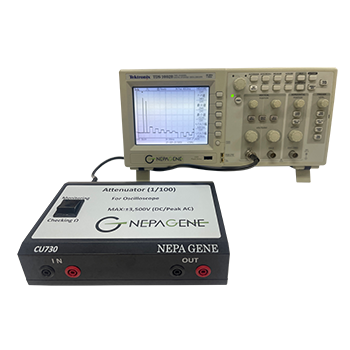
- 実体顕微鏡 SZX7(オリンパス社)とスーパーエレクトロポレーター NEPA21(ネッパジーン社)
- マイクロピペットを用いて、テトラメチルローダミン標識デキストランを卵管采付近の卵管壁を通して卵管内腔に注入
- インジェクション後、卵管領域をPBSで浸した適度な大きさに切ったキムワイプで覆いCUY652P2.5X4(Sピンセットお椀白金電極 2.5mm×4mm、ネッパジーン社)を使用してエレクトロポレーションを実施 Ova:卵巣、Ovi:卵管、Ute:子宮
- エレクトロポレーションのパルス波形
- NEPA21の設定電気条件
- Poring Pulse 電圧:40V、パルス幅:5msec、パルス間隔:50msec、回数:3回、減衰率:10%、極性:+/-(切替あり)
- Transfer Pulse 電圧:10V、パルス幅:50msec、パルス間隔:50msec、回数:6回、減衰率:40%、極性:+/-(切替あり)
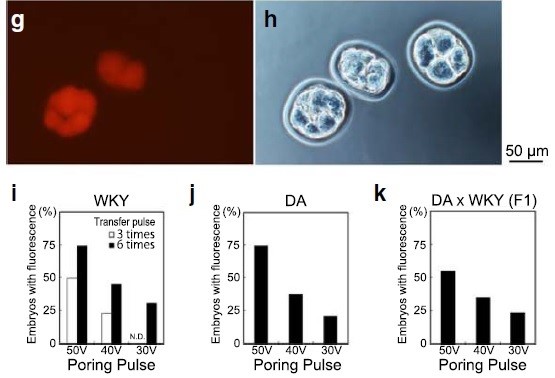
- h. テトラメチルローダミン標識デキストランの蛍光分析 スケールバー:50µm
- ラットWKYにおけるエレクトロポレーション効率の蛍光分析グラフ
- ラットDAにおけるエレクトロポレーション効率の蛍光分析グラフ
- ラットDA×WKYにおけるエレクトロポレーション効率の蛍光分析グラフ
rGONAD法によるTry遺伝子ノックアウト(KO)ラットの作製
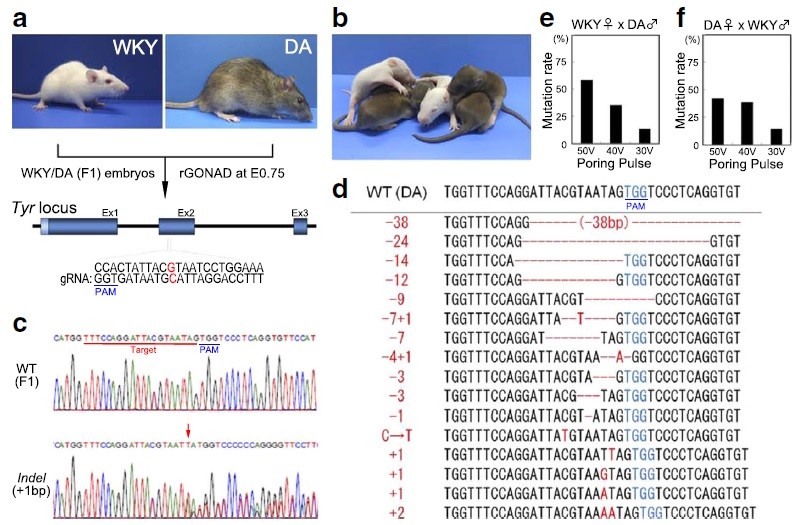
- KOラットにおけるアレル特異的ゲノム編集。
- ダークアグーチ(DA)系統のラットと交配させた妊娠0.75日のアルビノ(WKY)ラットでrGONAD法を実施した。
- 受精卵は(WKY×DA)F1ハイブリット。Tyr遺伝子座における標的の配列及びPAM配列。
- 編集中のラットには、アルビノの毛色を持つものもいた。
- 野生型F1(上段:WT)または編集型(下段:インデル)、ラットのダイレクトシーケンスの解析結果。赤矢印は、インデル変異。
- 仔の配列解析では、赤で示すようにTyr遺伝子座に様々なインデル変異が認められた。
- WKY雌×DA雄におけるTyr遺伝子のゲノム編集効率の分析。
- DA雌×WKY雄におけるTyr遺伝子のゲノム編集効率の分析。
ノックイン(KI)法を用いたアルビノWKYラットにおける毛色変異の修復
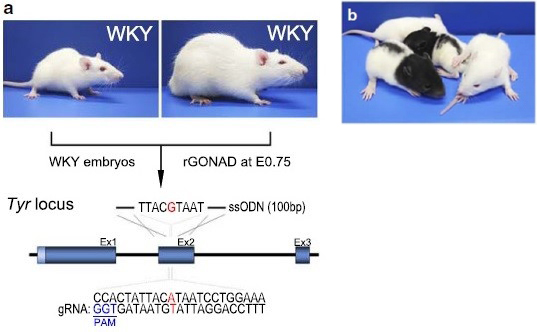
- 毛色変異の修復のスキーム
- WKY雄ラットと交配させた妊娠0.75日目のWKY雌ラットにrGONAD法を実施。
- Tyr遺伝子座における標的配列、PAM配列、およびssODNの図。
- 非アグーチで頭巾斑型のアルビノのKIラット
F1(WKY x DA)ラットのTyrを介した変異
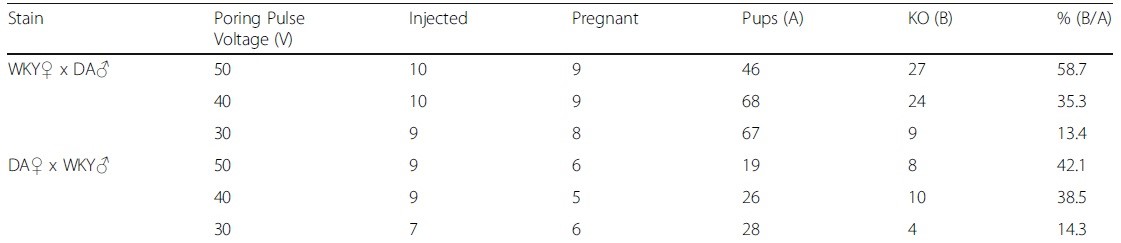
Kobayashi et al., BMC Biotechnology (2018)より一部引用。
データ提供:重井医学研究所 分子遺伝部門 松山誠先生
文献
- ノックアウトマウス
- ノックインマウス
Efficient genome editing in wild strains of mice using the i-GONAD method
Imai Y, Tanave A, Matsuyama M, Koide T.
Sci Rep. 2022 Aug 15;12(1):13821.
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産