藻類へのエレクトロポレーションによる遺伝子導入
アプリケーション
細胞壁溶解が不要な野生株クラミドモナスの迅速な形質転換法の確立
クラミドモナスは、バイオ燃料生産を含む多くの生物学的知見を研究するために広く用いられている真核単細胞緑藻である。
本研究では、矩形波電気パルスを利用したエレクトロポレーションにより、細胞壁を除去せずに野生型クラミドモナス株を迅速に形質転換する方法を確立した。 電気的条件の最適化により、工業的に有用な他の藻類の形質転換にも適用することができると期待される。
クラミドモナスの形質転換効率の比較結果
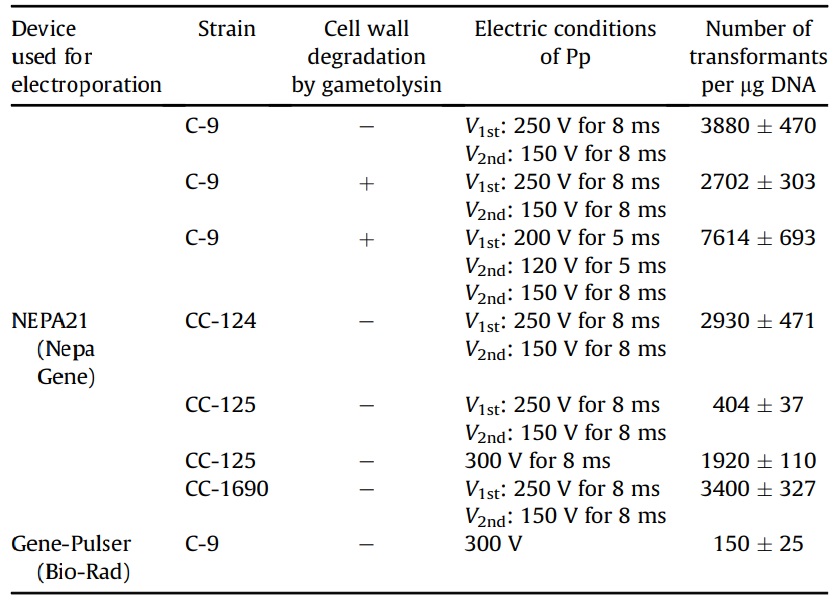
NEPA21を使用してクラミドモナスC-9株(細胞壁あり)を形質転換する場合、ポアーリングパルス:2回、電圧:250V、パルス幅:8 ms、パルス間隔:50 ms、減衰率:40%の条件で形質転換効率は最大となり、4×106個の細胞を形質転換した時にDNA 1 µgあたり3,880個の形質転換株が得られた。これは、既存のエレクトロポレーション法でC-9株の細胞壁を溶解させずに形質転換した時に得られた150個の形質転換細胞の約26倍であった。
また、ガメトライシン処理により細胞壁を溶解させたC-9株(プロトプラスト)では、最適条件時に、DNA1 µgあたり7,614個の形質転換株が得られた。
この形質転換法がC-9株だけでなく他の野生株にも適用出来るかどうかを調べるために、一般的に用いられているクラミドモナス野生株CC-124, CC-125, CC-1690の形質転換効率も調べた。
クラミドモナス形質転換株のコロニーの写真
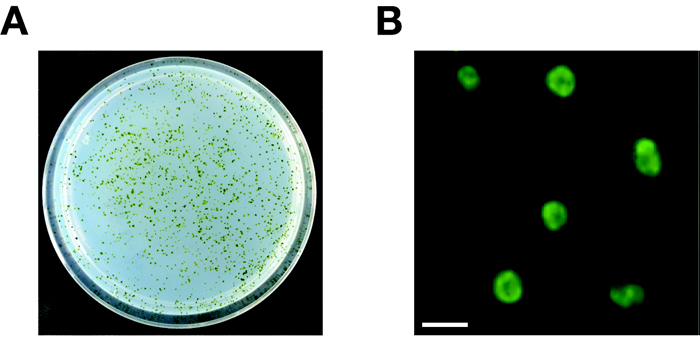
- NEPA21によりaphVIIカセット(ハイグロマイシンに対して耐性を付与するDNA断片)をクラミドモナス野生株に導入し、30 µg mL-1のハイグロマイシンBを含むTAP寒天培地に撒いた時の形質転換株のコロニー。
- NEPA21によりpTT1-LciB-GFPを導入して得られた形質転換株のLCIB-GFP由来の蛍光像。 はっきりとしたリング状の蛍光シグナルがピレノイド構造の周辺に観察される。スケールバー:5 µm
以前までの方法では、形質転換前にガメトライシンを調整するのに数日の時間が必要であった。 それに比べて、この方法を使えば、前準備なくDNAを直接野生株に導入することが可能である。 また、パルスの電気条件を検討することにより、クラミドモナス以外の有用な微細藻類の形質転換に利用することも可能であると考えられる。
京都大学大学院生命科学研究科 微生物細胞機構学分野 山野隆志先生・井口ひろ先生・福澤秀哉先生
※Journal of Bioscience and Bioengineering, Volume 115, Issue 6, Pages 691-694, June 2013 参考
多重パルス電気穿孔法を用いた珪藻フェオダクチラムの効率的な形質転換法
多重連続パルスによって外来DNAを細胞に導入する電気穿孔法を用いた羽状目珪藻フェオダクチラム(Phaeodactylum tricornutum)の高効率的な形質転換法を確立した。 エレクトロポレーターNEPA21のパルス条件を最適化することにより、珪藻の強固な珪酸質の被殻を除去することなく高い形質転換効率(10×8細胞あたり~4,500細胞の形質転換)を達成した。
これは、パーティクルガン法と今回と同じpPha-T1ベクターを用いた従来のフェオダクチラム形質転換方法に比べ10~100倍高い形質転換効率である。 この方法のさらなる利点はゼオシン耐性のコロニーを得るまでの期間が短いことである。 パーティクルガン法ではゼオシン耐性コロニーを得るまでにおよそ3~4週間かかるが、我々の方法では、電気パルス後10~15日でコロニーが得られる。 これは、珪藻細胞に対するダメージが小さく細胞壁を無傷で保つためである可能性が考えられる。
形質転換フェオダクチラム細胞におけるレポーター遺伝子のゲノムへの組込みと発現
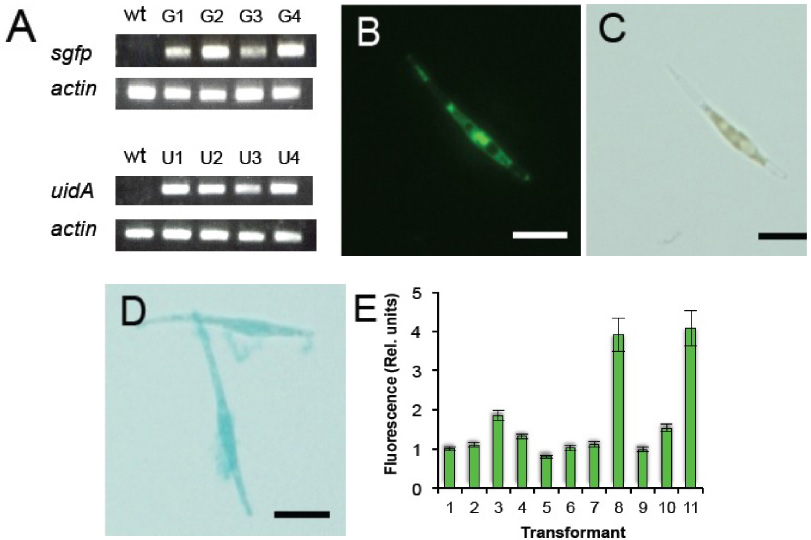
- 形質転換したフェオダクチラムのゲノムDNA 中のsgfp遺伝子, uidA遺伝子, actin遺伝子をPCR で増幅した。 野生型(wt)と4 つのゼオシン耐性珪藻ライン(G1-G4 = sgfp形質転換体、及び、U1-U4 = uidA形質転換体)から単離したゲノムDNA をPCR の鋳型に用いた。
- フェオダクチラムの顕微鏡写真。sGFP(S65T)タンパク質の存在が明るい緑色蛍光により示された。
- 明視野でのsGFP(S65T)を発現しているフェオダクチラム
- 明視野でのGUSを発現しているフェオダクチラム細胞の顕微鏡写真。GUS活性が青色染色によって検出されている。スケールバー:10μm
- sGFP を発現している形質転換フェオダクチラム細胞のラインごとの蛍光強度比較。それぞれの形質転換ラインの相対的な蛍光強度はImage Jにより評価した。値:5~6細胞の平均値±標準偏差
ゼオシン耐性コロニーのうち、約90%がレポーター遺伝子を発現しており、継代を繰り返してもレポーター遺伝子の発現は安定に維持されていることが確認された。
京都大学 生命科学研究科 伊福健太郎先生、兵庫県立大学 生命理学研究科 菓子野康浩先生 提供
※Bioscience, Biotechnology, and Biochemistry, Volume 77, Number 4, Pages 874-876, April 2013 参考
文献
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo・Ex Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo・Ex Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産