細胞増殖
細胞が増殖するとき、細胞数および細胞形態という2つの要因がインピーダンスの変化に作用します。ほとんどの場合細胞は非同期的に増殖していきます。インピーダンスは徐々に上昇し、細胞がコンフルエントになったときに最大となります。細胞がサブコンフルエントにある間は、細胞数に対してほぼ直線的に変化します。
アプリケーション
概要
ECIS測定は細胞増殖のモニタリングに使用でき、細胞や培養条件の様々な変化が、細胞モノレイヤーがコンフルエントに近づく速度にどのように影響するかを調べることができます。このような研究を行うために、電極に低い細胞密度の細胞を播種し、分裂していく細胞集団に余裕を持たせます。細胞数が増加するにつれて、広がった細胞で覆われる電極の面積が増加し、電極のインピーダンスが上昇します。これらのインピーダンスの変化は、相対的な細胞増殖速度、より正確には、基板が広がった細胞で占められるようになる速度に関連付けることができます。高い交流周波数で測定されたキャパシタンスの変化を観察することで、より定量的な測定が可能になります。
Joachim Wegener博士は、ECISのインピーダンス測定値が、増殖した細胞による基板占有率の違いに対してどのように変化するかをモデル化しました。この計算はMDCK-2細胞の特性を用いて行われ、40K Hzで測定されたキャパシタンスが、細胞被覆率の割合に応じて直線的に変化することを実証しています(Wegener, et al 2000)。この計算はMDCK細胞株に対してのみ行われましたが、一般的にこの相関関係はほとんどの株と初代細胞培養に有効です。この関係から、時間の関数として電極面積の被覆率を容易に追うことができます。
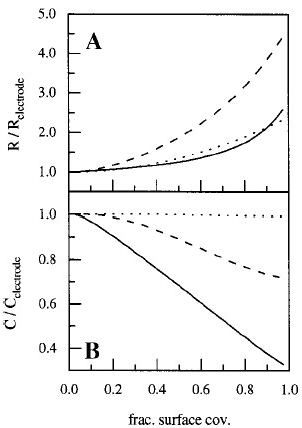
このグラフはECIS電極の抵抗(A)および静電容量(B)の計算値を、付着した細胞で表面を覆う割合の関数として示したものです。電極のパラメータを3つの異なる周波数(400 Hz (点線), 4 kHz(横線), 40 kHz (実践))でモデル化しました。より良い比較のために、両方の量は無細胞電極の対応する値で正規化されています。
ECISのアプローチは、広がった細胞によってブロックされた領域を測定し、細胞の数を直接測定するものではないことにご注意ください。本手法は有用な増殖関連データを得ることができ、必要に応じて細胞数の直接係数を伴う実験により検証が可能です。ECIS測定の魅力は、完全に自動化されており、最小限の操作しか必要としないことです。一旦細胞を電極アレイに加えたら、インキュベーターのドアは閉じたままで、必要であれば数日間データを収集することができます。これらのアッセイには、10個の個別電極で基盤がカバーされている、8W10E電極をお勧めします。電極はウェル底面の異なる位置に配置され、培養の全体的な状態について、より統計的に適切な測定を可能にしています。
軟骨細胞増殖データの測定
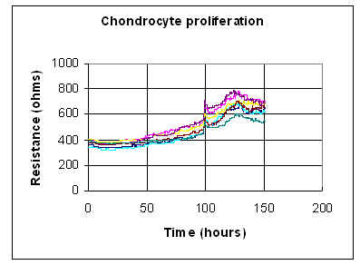
活発に増殖している軟骨細胞をECISウェルに播種し、1cm2あたり約1×104個の初期表面濃度としました。合計7個のECISウェルに接種し、10分ごとのインピーダンス測定を150時間以上にわたり継続しました。この研究で使用された電極アレイは、各ウェルに並列に接続された10個の小型電極を持つ8W10Eでした。下のプロット図は、4,000Hzでのレジスタンス値の経時的変化を示しています。播種後100時間で培地交換を一度行いました。
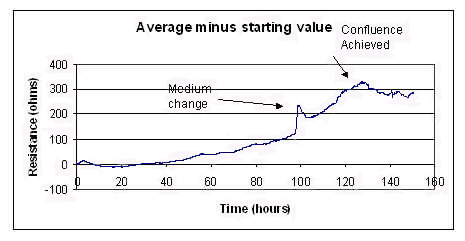
右図は同じデータにおいて、7個のウェルの平均レジスタンス値から細胞を播種していない電極でのレジスタンス値を引いた場合の経時変化を示したものです。100時間経過後の培地交換により、コンフルエントになるまでの間、グラフの指数関数的な外観から一時的に逸脱しています。その後のインピーダンスの変化は、細胞がレイヤーに押し寄せ、細胞どうしの接触領域が増えることで、抵抗がわずかに低下するために起こると推定されます。高周波数でのキャパシタンス測定を行うことで、この要因は実質的に排除できます。
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産