受精卵へのエレクトロポレーションによるゲノム編集(TAKE法)
アプリケーション
エレクトロポーション法による哺乳類受精卵へのZFN, TALEN, CRISPR–Casの導入
本研究成果のポイント
- エレクトロポーション法(電気穿孔法)を用いて、遺伝子改変動物(ラット)の作製に世界で初めて成功した。
- 本方法を用いて、近年注目されているZFN, TALEN, CRISPR-Casの受精卵への導入に成功し、ゲノム編集技術の加速化を推進させる技術として利用できる。
- エレクトロポーション法は、マイクロインジェクション法よりも操作が容易であり、熟練した作業者が不在の研究機関・研究室で、目的遺伝子を改変した動物を容易に作製することができる。
- 多くの動物種の受精卵への遺伝子導入に応用可能であり、研究に適した動物種を用いて短期間で遺伝子改変動物を準備することができ、研究効率を向上できる(マウス・ラットのノックアウト・ノックインにも成功)。
- 本技術は、Technique for Animal Knockout system by Electroporation(TAKE法:テイク法)と命名した。
実験内容
写真A & B

図C
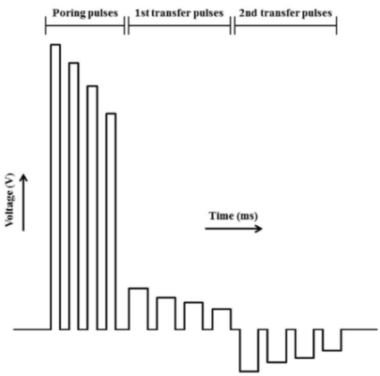
図D
写真E

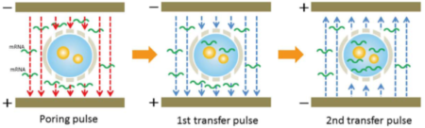
本研究では、写真A:NEPA21スーパーエレクトロポレーター(ネッパジーン社)と写真B:CUY520P5シャーレ白金プレート電極 5mm gap(ネッパジーン社)を使用して、図C:3ステップの電気穿孔を設定し、1ステップ目の電気パルスで細胞に穴を空け、2ステップ及び3ステップ目の電気パルスで遺伝子を導入するという段階的な方法で、効率的に受精卵内へ遺伝子を導入した。(図D)
胚に外来物質をエレクトロポレーションで導入する際の条件検討の為に、テトラメチルローダミンでラベルされたデキストラン(3kDa、可視化が容易で細胞毒性が無い)を用いた。 前核期の胚は、交尾後一日経過した過剰排卵メスラットより採取した。 テトラメチルローダミンでラベルされたデキストランをパルス幅:0ms(コントロール), 0.5ms, 1.5ms, 2.5msecの条件でラット胚にエレクトロポレーションした。 デキストランは胚の細胞質全体に導入された。(写真E)
研究方法と結果
標的遺伝子は、X連鎖重症複合免疫不全症(X-SCID)の原因遺伝子であるインターロイキン2受容体γ鎖(Il2rg)遺伝子として、ZFN, TALEN, CRISPR-CasのmRNAを作製した。 NEPA21に接続したCUY520P5シャーレ電極にmRNAを混合した溶液を満たし、そこへ受精卵を入れてTAKE法のエレクトロポレーションによりmRNA導入を行った。 導入後の受精卵は、雌親へ移植し産子にまで育てた。 その結果、ZFN, TALEN, CRISPR-Casの全てにおいて、目的の遺伝子が破壊された産子を得ることに成功した。
今後の期待
これまで、遺伝子改変動物の作製には繊細かつ熟練した技術が必要とされ、そのことが研究遂行の妨げになっていた。 今回開発したTAKE法を用いることにより、簡易に短期間で目的の遺伝子を改変した動物を作製することが可能となった。 本研究成果は、遺伝子改変動物を必要とする研究の加速化に大いに貢献できるものであり、今後他の動物種での成功が期待される。
京都大学大学院医学研究科 附属動物実験施設 金子武人先生・真下知士先生
※Simple knockout by electroporation of engineered endonucleases into intact rat embryos, Scientific Reports 4: 6382 DOI: 10.1038/srep06382 参考
文献
- ラット受精卵
- ノックアウト
- ノックイン
Reproductive technologies for the generation and maintenance of valuable animal strains.
Kaneko T
J Reprod Dev. 2018 Jun 22;64(3):209-215
- マウス受精卵
- ラット受精卵
- ノックアウト
- ノックアウト
Genome Editing in Mouse and Rat by Electroporation
Kaneko T
Methods Mol Biol, 1630, 81-89 2017
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo・Ex Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo・Ex Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産