ニワトリ(In Ovo・その他)へのエレクトロポレーションによる遺伝子導入
アプリケーション
In Ovoエレクトロポレーション法によるニワトリ脳胞への遺伝子導入
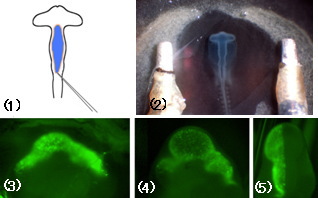
- ニワトリ1.5日胚の脳胞へFast Greenを含むプラズミド溶液(青色)を注入する。
- 脳胞の左右に平行電極を置き、25V、50msの電圧を1秒間隔で4回かける。
- GFP遺伝子を導入した場合、24時間後にはGFP蛍光が各脳胞で強く検出される。
- GFP遺伝子導入48時間後でもGFP蛍光が検出される。
- 図4の胚を上部から見ると、遺伝子導入は胚の右側の脳胞に限局されていることがわかる。
本方法により、転写因子(Engrailed, Pax, Otx2, Gbx2)、分泌因子(Fgf, Shh, Semaphorin)、受容体(Neuropilin)などの局所導入をおこない、脳胞の形態変化、領域の改変、軸索走行の異常、下流遺伝子の発現変化などが検出される。
また、siRNAの導入による遺伝子発現抑制実験も可能である。
東北大学生命科学研究科 加齢医学研究所 仲村春和先生・渡邉裕二先生 提供
※Development Growth & Differentiation, Volume 42, Issue 3, Page 199-201, June 2000 参考
エレクトロポレーション法を用いたニワトリ胚でのsiRNAによる遺伝子機能阻害法
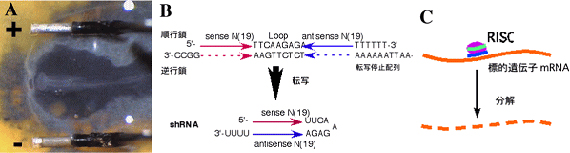
- プラスミド液を神経管内に吹き入れ、電極を卵黄膜の上に置く。 25V、50msec/secの矩形波を4回流す。
- 転写によってヘアピン型siRNA (shRNA)が形成される配列をデザインし、U6プロモーターやH1プロモーターを持つ発現ベクターに組み込む。 当研究室では、マウスのU6プロモーターを持つベクターを用いているが、ニワトリ胚でも効果がある。
- 転写後、ヘアピン部分が消化され、siRNAとなりRISC(RNA induced silencing complex)を形成し、標的遺伝子のmRNAを分解する。
エレクトロポレーション後24時間
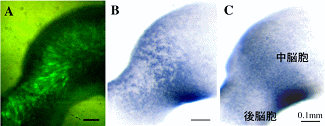
- 導入効率を共導入したGFPにより検出。
- En2に対するshRNAを設計。 in situ hybridizationによってmRNAの分解を検出した。
- En2の正常な発現。エレクトロポレーション法とsiRNA法を組み合わせることで、簡便な遺伝子の機能阻害法を実現できる。
東北大学生命科学研究科 加齢医学研究所 仲村春和先生・片平立矢先生 提供
※Mechanisms of Development, Volume 121, Issue 9, Pages 1137-1143, September 2004 参考
ニワトリ初期胚(原腸陥入胚)への遺伝子導入
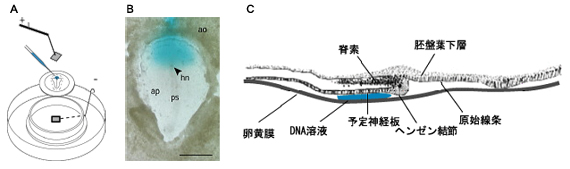
- Newカルチャーエレクトロポレーションの模式図
- DNA溶液(FastGreenにより青緑色がついている)をステージ4ニワトリ胚の予定神経板領域に注入したところ。hn:ヘンゼン結節、ps:原始線条、ao:area opaca、ap:area pellucida
- DNA溶液のインジェクションの模式図 卵黄膜と予定神経板の隙間に注入する。
プロトコル:
- 濾紙リングに胚を貼り付け、卵より取り出す。
- 余分な卵黄を洗い、陰極チャンバーのプラットフォーム上に静置する。
- ガラスニードルを用いてDNA溶液を卵黄膜と外胚葉の隙間に注入する(外胚葉系組織に導入する場合)。
- 標的部位を陰極板上に設置し、陽極をその上に設置する(電極間は5mm)。
- 設定電圧10V、パルス時間50ms、パルス間隔100ms、回数5回のパルスをかける。
- 卵白寒天プレート上に移し、39℃で培養する。
エレクトロポレーション後の導入遺伝子の発現
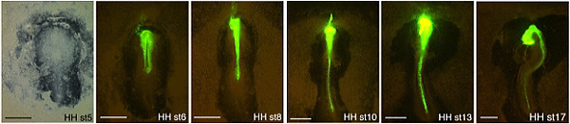
プロトコールの条件でステージ4の予定神経板領域にGFP遺伝子を導入し、蛍光実体顕微鏡下で経時的にステージ17(約34時間後)まで観察した例を示す。
導入されたGFP遺伝子は、エレクトロポレーション後約3時間頃より発現が観察され、中枢神経系と頭部表皮に強く発現していた。
さらに、標的領域における陽性細胞を定量したところ、約80%以上の細胞が発現していた。
他の部位への導入
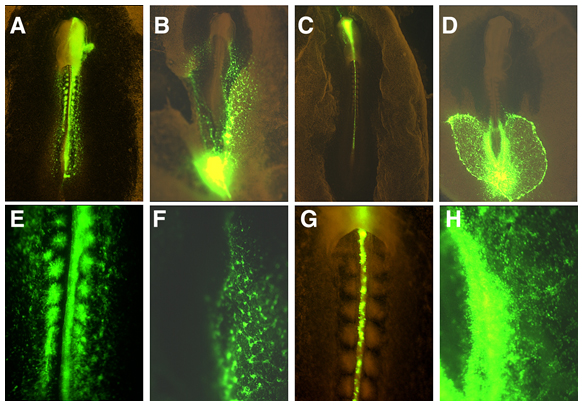
ニワトリ胚の予定運命地図に基づいて、導入時期、導入部位、電極の設置部位を変えることにより、体節、血球系、側板、脊索などに発現させることが可能である。
- 体節
- 血球系
- 脊索
- 側板
- ~H. A~Dの拡大した例
熊本大学発生医学研究センター 形態形成分野 嶋村健児先生 提供
※メディカル ドゥ社「図・写真で観る発生・再生実験マニュアル」 転載
エレクトロポレーション法によるニワトリ胚消化器官への遺伝子導入
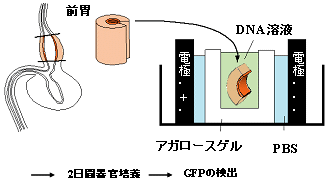
- ウェッケルの刃の片方を前胃の内腔に挿入し、切開しPBS(-)に移す。
- ゲルを電極におさまるように適当な大きさに剃刀で切り、PBS(-)に浸しておく。
- ゲルを電極に納め、周囲をPBS(-)で満たす。 ウェルの内側のPBS(-)をピペットマン(P200)で丁寧に吸い取って除き、プラスミドDNA溶液(12~15μl)で満たす。 前胃を上皮が陰極に向くようにして入れる。
- 設定電圧30V、パルス時間50msの電圧を、75msの間隔で15回掛ける。 ただちにゲルを取り出し、サリエールに入れたダイロード液で濯ぐ。 前胃を取り出し、新たなダイロード液に移す。
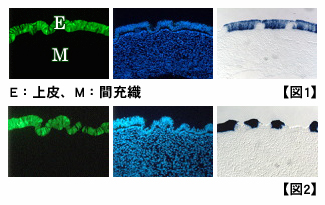
腺形成のメカニズムを研究するために、上皮細胞に種々の遺伝子を導入し、その機能解析を行っている。 ここでは、その対照実験として、5.5日胚前胃の上皮に、GFP発現ベクターをエレクトロポレーション法で導入した例を示す。
2日間培養後、導入した遺伝子(GFP)の発現が上皮のみに見られる。 上皮の陥入が始まり、cSP遺伝子の発現が消失し始めている【図1】。 3日間培養後、胃腺が形成され、内腔上皮でcSP遺伝子が正常に発現していることから、エレクトロポレーション法による異常がないことが分かる【図2】。 GFPは内腔上皮でも腺上皮でも発現している。
東京都立大学大学院理学研究科生物科学専攻 八杉貞雄先生 提供
文献
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo・Ex Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo・Ex Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産