iPS細胞・ES細胞・幹細胞などへのエレクトロポレーションによる遺伝子導入
iPS細胞を始め様々な幹細胞にも、高価な専用試薬・バッファー不要で、簡単かつ非常に効率の良いトランスフェクションが可能です。
アプリケーション
iPS細胞・ES細胞・幹細胞への遺伝子導入例
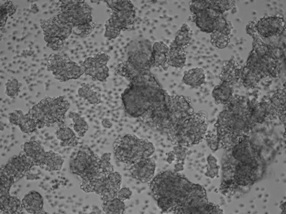
ヒトiPS細胞
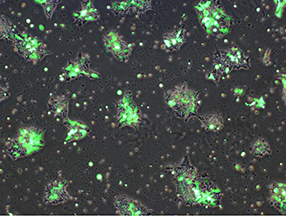
エレクトロポレーション後3日目
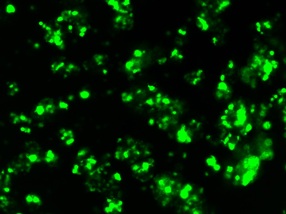
ヒトiPS細胞
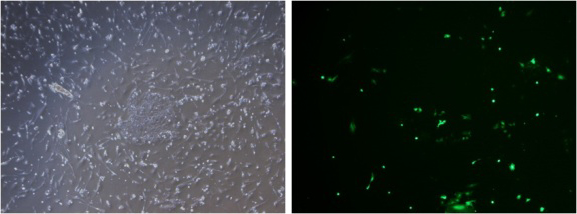
エレクトロポレーション後2日目 (コロニーの部分に導入されている 。)
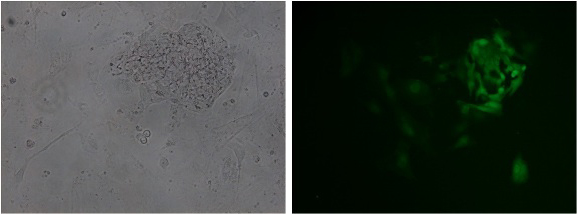
エレクトロポレーション後7日目 (継代後も、iPS細胞コロニーでGFPが発現している 。)
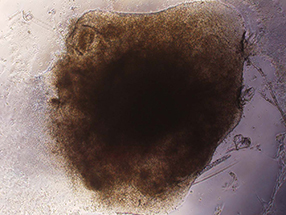
マウスES細胞
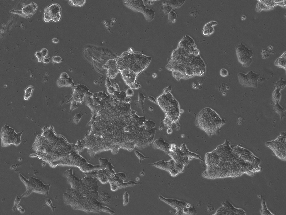
生存率:74%
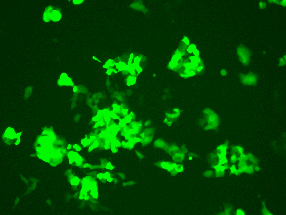
導入効率:88%
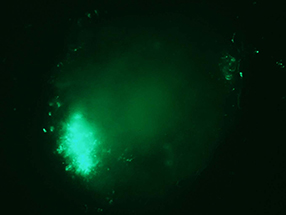
マウスNeurospheres
生存率:90%
導入効率:75%
ヒトiPS細胞 胚葉体(接着状態)
iPS細胞の作製
疾患iPS細胞(LQT)の作製
B細胞へのエピソーマルベクターを用いた初期化因子の導入
疾患iPS細胞(LQT):EP後およそ1ヶ月のiPS細胞のコロニー。(対物 x5)
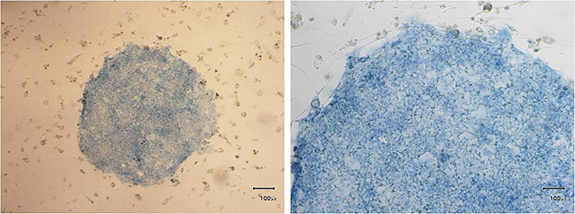
アルカリホスファターゼ染色。(左:対物 x4 右:対物 x10)
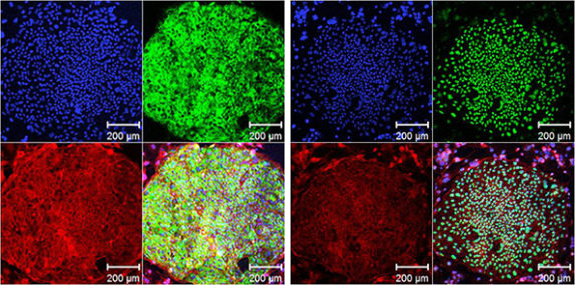
疾患(LQT)iPSコロニーの免疫染色。
未分化マーカー TRA1-60 (細胞表面抗原), OCT4 (核)の発現は非常に良好である。
青:DAPI(核) 緑(左):TRA1-60 緑(右):OCT4 赤:ファロイジン(重合型アクチン)
東京女子医科大学 国際分子細胞免疫研究センター 循環器小児科 中西敏雄研究室 ご提供
NEPA21トランスフェクションによるヒトiPS細胞のCRISPR活性評価

- ヒトiPS細胞株におけるNEPA21スーパーエレクトロポレーター(ネッパジーン社)を用いたトランスフェクション条件の最適化。Poring Pulseの電圧とパルス幅を検討した。 EGFP発現プラスミドをトランスフェクションし、LSRFortessaセルアナライザー(BD社)を用いて陽性細胞の割合を解析した。
- トランスフェクション手順の概略
- Cas9発現ベクターpHL-EF1a-SphcCas9-iP-A(Addgene ID: 60599)とsgRNA発現ベクターpHL-H1-ccdB-mEF1a-RiH(Addgene ID: 60601)をiPS細胞にエレクトロポレーションした後、内在性ジストロフィン遺伝子の切断活性をT7EIアッセイで評価した。切断されたバンドの強度(◀赤矢印)をTapeStation(Agilent)で検出し、その値はゲルエレクトログラム画像の下に示す。
- Cと同じゲノムDNAサンプルを制限酵素XcmI(50-CCANNNNN^NNTGG-30)を用いたRFLPで分析した。切断されていないバンドの強度は、◀赤矢印に示す。gRNA5は、XcmI部位から遠く離れた場所で切断するため、RFLPアッセイでは切断活性は検出されなかった。
京都大学 iPS細胞研究所 臨床応用研究部門 李紅梅先生・堀田秋津先生 提供
iPS細胞・ES細胞・幹細胞への遺伝子導入結果一覧
細胞名をクリック頂きますと、細胞の写真がご覧頂けます。
| 細胞名 | 生存率 | 導入 | 細胞名 | 生存率 | 導入 | |
| ヒトiPS細胞 (201B7) | 86% | 70% | ヒトiPS細胞 (201B7) | 94% | 80% | |
| ヒトiPS細胞 | ヒトiPS細胞 | |||||
| ヒトiPS細胞 (201B7) | ヒトiPS細胞 (201B7) | |||||
| ヒトiPS細胞 | 69% | 80% | ヒトiPS細胞 | 73% | ||
| ヒトiPS細胞由来神経細胞 | 93% | 54% | ヒトES細胞 | |||
| ヒトES細胞(H9 p.51) | 55% | 55% | ヒト間葉系幹細胞(hMSC) | 96.2% | 96.7% | |
| ヒト間葉系幹細胞(プライマリー) | 78% | 75% | ヒト間葉系幹細胞(hMSC) | 70% | 80% | |
| ヒト神経幹細胞 | 97% | 95% | ヒト神経幹細胞 | 80% | 83% | |
| ヒト乳歯歯髄幹細胞(SHED) | 90% | 92% | ヒト造血幹細胞を含む有核細胞 (精製前段階) | 73% | 90% | |
| ヒト脂肪由来幹細胞(ASC_P5) | 87% | 65% | ||||
| マウスiPS細胞 | 70% | 50% | マウスES細胞 | 80% | 75% | |
| マウス ES細胞 | 80% | 68% | マウス ES細胞 | 74% | 88% | |
| マウス ES細胞 (129系統 R1/E) | 80% | 90% | マウスES細胞 | 70% | 100% | |
| マウス ES細胞 | 80% | 90% | マウスiPS細胞由来神経幹細胞 | 86% | ||
| マウス神経幹細胞 | 90% | 80% | マウス神経幹細胞(プライマリー) | 80% | 60% | |
| マウス神経幹細胞塊(Neurospheres) | 90% | 75% | マウス神経幹細胞塊(Neurospheres) | |||
| TS マウス栄養膜幹細胞 | 59% | 47% | C3H/10T1/2 マウス間葉系幹細胞 | 70% | 85% | |
| マウス間葉系幹細胞 | 99% | 89% | マウス造血幹細胞(c-Kit陽性細胞) | 66% | 45% | |
| ラットES様細胞 | 70% | 76% | ラットWDA ES様細胞 | 60% | 80% |
文献
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo・Ex Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo・Ex Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産