肝臓・皮膚・血管・その他
アプリケーション
ソノポレーション法によるニワトリ胚への遺伝子導入 [文献1]
♦ソノポレーション法の手順

A, B: DNA-マイクロバブル混合液をガラスキャピラリーを用いてニワトリ胚肢芽へインジェクションする。
C: インジェクションした領域はマイクロバブルにより白っぽく見え、可視化できる。
D: 超音波照射端子(Ultrasound probe)を用いて(写真は経3 mmの端子)、超音波を照射する。
F: 導入終了。白っぽく見えていたマイクロバブルは破裂し、消失する。
♦GFP遺伝子導入後の発現の経時的変化

ニワトリ胚ステージ20~21の肢芽間葉へpEGFPを導入した。
A, E: 導入後、3時間後にはすでに発現が見られる。
B, F: さらに6時間後には発現が強くなる。
C, G: 12時間後には発現のピークに達する。
D, H: 24時間後には発現は次第に弱くなるが、少なくとも発現は48時間持続する。
スケールバー:A, Eとも1mm
♦LacZ遺伝子のニワトリ胚肢芽への導入

A: HHステージ20~21の肢芽間葉にLacZ遺伝子を導入し、12 時間にβガラクトシダーゼの検出を行った。 白線はBの切片の位置を示す。
B: βガラクトシダーゼポジティブな細胞(青)は肢芽間葉内においてパッチ状に検出される。
♦過剰指の誘導

A: HHステージ20~21の肢芽間葉へpEGFPのみ及び、pEGFPとpCAGGS-cShhのco-injectionを行い、12時間後GFPの検出を行った。スケールバー:1mm
B: GFP遺伝子のみを導入した肢芽は正常な翼を形成した。
C: pEGFPとpCAGGS-cShhのco-injectionを行った肢芽は過剰な第三指(3’)が誘導された。
数字は指の番号を示す。 *:余剰な軟骨の断片
♦肢芽間葉への連続遺伝子導入

HH ステージ20~21の肢芽間葉の前方へ遺伝子を導入した後、連続して後方にも遺伝子を導入した。 12時間後、肢芽の前方と後方の間葉にGFP の発現を確認した。
スケールバー:1mm
熊本大学生命資源研究・支援センター・動物資源開発研究部門(CARD) 太田将氏・山田源先生 提供
※秀潤社「細胞工学 Volume 23, Number 1, 248-251ページ, 2004年1月号」 転載0
ソノポレーション法によるマウス胚の外生殖器、ニワトリ胚の肢芽への遺伝子導入 [文献2]
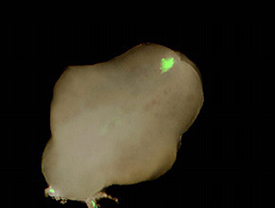
♦マウス胚の外生殖器(E13.5)にGFP遺伝子(pCAGGS-GFP)を導入し、12時間の器官培養後、GFP発現を観察した。
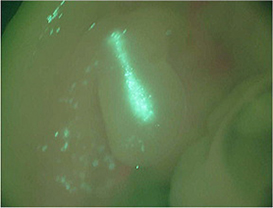
♦ニワトリ胚の肢芽(day3)にGFP遺伝子(pCAGGS-GFP)を導入し、24時間後、GFP発現を観察した。
超音波を用いたブタ卵子活性化法 [文献3]
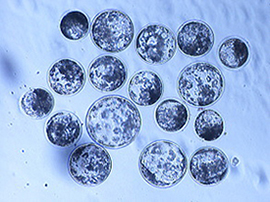
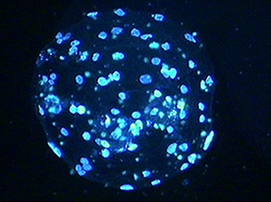
♦超音波によって活性化した卵母細胞から発育したブタの胚盤胞
超音波の照射条件は次の通りです。
エネルギー:2.0W/cm2、デューティーサイクル:10%
照射時間:30秒
ソルビトールベースの培地を使用 胚盤胞をヘキスト33342で染色した画像
鹿児島大学 農学部 生物生産学科 三好和睦先生 提供
超音波遺伝子導入治療法による象牙質再生 [文献4]
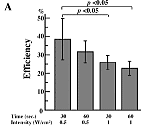

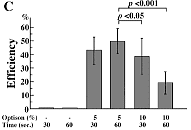
♦歯髄幹細胞への超音波遺伝子導入の最適化
図A: 超音波の強度と照射時間による遺伝導入の変化(オプチゾン10%、周波数1MHz)
歯髄組織にCMV-LacZベクターを導入して48時間後、凍結切片にしてβガラクトシダーゼ発現細胞の比率を数え効率を測定した。 強度0.5W/cm2、照射時間30秒の時、最適の結果を得た。
図B: 歯髄組織の中へのpEGFPベクター遺伝子導入とオプチゾンの濃度
(超音波条件:周波数1MHz、強度0.5W/cm2、照射時間30秒)
オプチゾン5%で、最適の結果を得た。 20%では減少し、50%で激減した。
図C: オプチゾンの濃度と照射時間 濃度5%が最適で、照射時間30秒~60秒の時、最適の結果を得た。

In Vitro器官培養による象牙芽細胞のマーカーdentin sialophosphoprotein (Dspp) mRNAの発現誘導 歯髄組織は、抜歯後に切断されて、pEGFP-TIMP(A)、CMV-LacZベクター(B, C)、及びpEGFP-TIMP-Gdf11ベクター(D)を遺伝子導入して器官培養された。
図A: 共焦点レーザー顕微鏡下でGFPを観察したところ、切断面から深さ500μmにまで、歯髄細胞内にGFP遺伝子が取り込まれていることが判明した。
図B: βガラクトシダーゼ染色により切断面(矢印)の歯髄組織は、均一に遺伝子が導入され、非侵襲で、壊死がないことが判明した。
図C: 超音波遺伝子導入された領域の歯髄細胞の導入遺伝子LacZ発現(矢印)。
図D: 超音波遺伝子導入7日後、whole-mount in situハイブリダイゼーション解析により、切断面から深さ500μmまでDSPP mRNA発現(矢印)がみられた。

イヌ歯髄切断面にgrowth differentiation factored 11 (Gdf11)をIn vivo超音波遺伝子導入後、1ヶ月所見。
pEGFP-TIMP-Gdf11ベクター(A-C) 40μgとコントロールとしてpEGFP-TIMPベクター(D) 40μgを周波数1MHz、強度0.5W/cm2、照射時間30秒の条件で超音波遺伝子導入。
図A: 歯髄切断面に細菅象牙質(TD)と修復象牙質(OD)の形成がみられる。
図B: 新しく形成された細菅象牙質(TD)の高倍率 長い細胞突起(矢印)をもつ象牙芽細胞様細胞がみられる。
図C: 象牙芽細胞(矢印)周囲に基質が産生され、修復象牙質(OD)中に象牙芽細胞が埋もれている。
図D: コントロールは、細菅象牙質(TD)と修復象牙質(OD)の形成がみられない。
国立長寿医療センター研究所口腔疾患研究部 口腔機能再生研究室 中島美砂子先生 提供
※Human Gene Therapy, Volume 14, Number 6, Pages 591-597, April 2003 参考
バブルリポソームによる超音波遺伝子デリバリー

PEG-リポソーム

バブルリポソーム
図1:バブルリポソームの外観
PEG修飾リポソームに超音波造影ガスであるパーフルオロプロパンを封入してバブルリポソームを調整した。

Optison

バブルリポソーム
図2:バブル製剤の顕微鏡観察
バブルリポソームをダークライト(暗視野用光ファイバー照明器具:ネッパジーン社)を用いて顕微観察してみたところ、市販されているマイクロバブルOptison(GE Healthcare社)より小さい粒子であることが判明した。
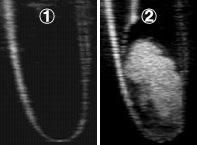
図3:バブルリポソームの超音波造影
バブルリポソームは高輝度の超音波造影ガスであるパーフルオロプロパンを封入したバブル製剤であり、超音波造影装置による造影が可能であると考えられる。 そこで、バブルリポソームへのガス封入を確認する目的で、超音波診断装置による超音波造影を行った。 その結果、![]() ガス未封入リポソームでは陰影像(黒色部)のみしか認められなかった。
ガス未封入リポソームでは陰影像(黒色部)のみしか認められなかった。
一方、![]() バブルリポソームの超音波造影では、リポソーム存在部においてエコーシグナルの増強が認められ、ガスの存在が確認できた。
バブルリポソームの超音波造影では、リポソーム存在部においてエコーシグナルの増強が認められ、ガスの存在が確認できた。
①小動物用超音波エコー装置:NP60R-UBM
(ネッパジーン社)
②心臓の造影 (バブルリポソーム投与前)
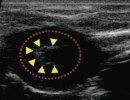
③心臓の造影 (バブルリポソーム投与後)
②心臓内腔の造影方法

⑤膀胱の造影 (バブルリポソーム投与前)
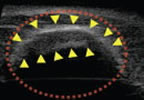
⑥膀胱の造影 (バブルリポソーム投与後)
図4:バブルリポソームによる心臓と膀胱の超音波造影
バブルリポソームのIn Vivoにおける超音波造影効果を評価した。
マウス尾静脈よりバブルリポソームを投与し心臓における造影効果を確認したところ、バブルリポソーム投与による心臓内エコーシグナルの増強が認められた。
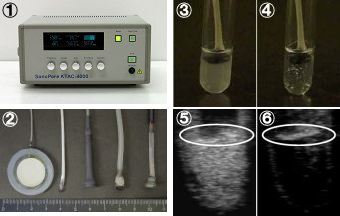
図5:バブルリポソームへのキャビテーション誘導
1 超音波照射装置:ソノポール4000 (ネッパジーン社)
2 超音波照射プローブ (ネッパジーン社)
3 バブルリポソームの外観 (超音波照射前)
4 バブルリポソームの外観 (超音波照射後)
5 バブルリポソームの超音波造影 (超音波照射前)
6 バブルリポソームの超音波造影 (超音波照射後)
※5・6の白色楕円内:超音波照射プローブ
バブルリポソームに超音波を照射すると、バブルリポソーム懸濁液の透明化及び超音波造影剤としての超音波エコーシグナルの減弱が認められた。 このことよりバブルリポソームにキャビテーションが誘導されたものと考えられた。
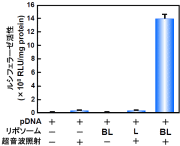
図6:バブルリポソームを用いた培養細胞への超音波遺伝子導入
COS-7細胞懸濁液にpCMV-Luc (5μg)およびバブルリポソーム(60μl)を添加し、超音波照射(周波数:2MHz、Duty Cycle:50%、Burst Rate:2Hz、照射強度:2.5W/cm2、照射時間:10秒)した。 超音波照射後に細胞を洗浄し、2日間培養後ルシフェラーゼ発現を確認した。
※BL:バブルリポソーム、L:ガス未封入リポソーム プラスミドDNA(pDNA)とバブルリポソームを混合し超音波照射した群では、他の群に比べ極めて高い遺伝子発現が認められた。
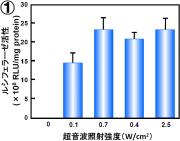
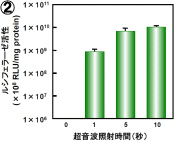
図7:超音波遺伝子導入における超音波照射条件の影響
共通条件:周波数:2MHz、Duty Cycle:50%、Burst Rate:2Hz
1 照射強度:0~2.5W/cm2、照射時間:10秒
2 照射強度:2.5W/cm2、照射時間:0~10秒
プラスミドDNA(10μg/ml)およびバブルリポソーム(120μg/ml)をCOS-7細胞懸濁液に添加し、超音波照射した。 超音波照射後に細胞を洗浄し、2日間培養後ルシフェラーゼ発現を確認した。
非常に興味深いことに、たった1秒間の超音波照射でも効率よく遺伝子導入可能であることが判明した。 このことから、本方法が瞬時に細胞内への遺伝子導入可能な方法であることが示唆された。
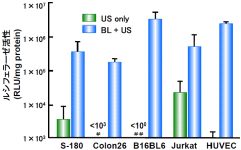
図8:各種培養細胞とバブルリポソーム併用の効果
各種の細胞懸濁液にpCMV-Luc (5μg)およびバブルリポソーム(60μl)を添加し、超音波照射(周波数:2MHz、Duty Cycle:50%、Burst Rate:2Hz、照射強度:2.5W/cm2、照射時間:10秒)した。 超音波照射後に細胞を洗浄し、2日間培養後ルシフェラーゼ発現を確認した。
※US:超音波照射
各種培養細胞とも、超音波照射した通常のソノポレーションと比べ、バブルリポソームを混合し超音波照射した群では、極めて高い遺伝子発現が認められた。
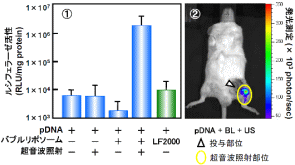
図9:バブルリポソームと超音波の併用によるIn Vivo遺伝子導入
プラスミドDNA(10μg)とバブルリポソーム(250μg)混合液、またはプラスミドDNA(10μg)とリポフェクタミン2000(50μg)の複合体をマウス下肢動脈に投与し、投与と同時に、その下流部位を体外から超音波照射(周波数:1MHz、Duty Cycle:50%、Burst Rate:2Hz、照射強度:1W/cm2、照射時間:2分)した。
1 動脈血管におけるルシフェラーゼ発現(2日後)
2 ルシフェラーゼ発現部位の確認(IVIS)
※IVIS:ルシフェラーゼIn Vivoイメージングシステム
バブルリポソームと超音波の併用において高いルシフェラーゼ活性が認められた。 また、この遺伝子発現はリポフェクタミン2000 を用いた既存のリポフェクション法より高く、バブルリポソームと超音波の併用が優れた非ウイルスベクター遺伝子導入システムになり得ることが示された。
今後の展望
これまでの医学において、診断と治療は異なる領域として捉えられていた。 しかし、超音波造影剤は単なる診断用製剤ではなく、治療にも応用可能であることが示唆された。 今回紹介したような特性を有するバブルリポソームが、次世代型バブル製剤として超音波診断のみならず超音波治療や遺伝子デリバリーツールに利用され、新たな医療システム構築に貢献できることを期待したい。
帝京大学薬学部生物薬剤学教室 鈴木亮先生・宇都口直樹先生・丸山一雄先生 提供
※Mebio Oncology, Volume 4, Number 2, Pages 36-47, 10 June 2007 参考
文献
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産