自家蛍光消光装置 TiYO™

自家蛍光消光装置 TiYO™
デモ依頼受付中!- 特許取得(特許第7783603号)-
- 高効率LEDと独自の冷却システムにより組織を傷めずに自家蛍光物質を消光
- 組織染色の前処理として短時間(30分~2時間)の使用での効率的な消光を実現
アプリケーション
製品説明
特長
- ISHpalette™によるin situ shHCR染色、その他の蛍光ISHや免疫染色のお供に
- 自家蛍光の強い生物種や成体組織の蛍光染色観察に最適
- 難しい操作、特別な試薬は不要
TiYO™とは
蛍光色素を用いて組織における様々な遺伝子の発現やタンパク質量をモニターすることは生命現象を理解するために必須のアプローチであり、日々進歩しています。生体物質の組織における検出においては、シグナルを強くする「高感度化」も重要ですが、ノイズを減らす「低ノイズ化」も同様に重要です。組織の観察におけるノイズは様々な要因で生じます。そのうちの一つが自家蛍光を発する物質であり、老化などによって細胞内に蓄積されるリポフスチン顆粒や、エラスチン線維、ビタミンAなどが蛍光を発することが知られています。このような物質から生じる自家蛍光は、染色によって人為的に標識された蛍光と区別をつけることが難しいため、研究者を悩ませてきました。
これまでの自家蛍光への対処法としてよく用いられてきた試薬による消光では、本来検出したい蛍光色素由来の蛍光シグナルまでも減弱させてしまったり、特定の蛍光波長でノイズを増やしてしまうなどの欠点がありました。試薬を用いないアプローチの一つとして、強力な光照射による消光も試みられてきました。しかし、これまでの報告ではスライドガラス1枚を全て消光するまでに数時間から数日を必要とする、光による熱発生で組織が変性してしまうなどの欠点があり、実用化には多くの障壁がありました。
照射する光の波長、光源の種類、光の当て方を最適化することで消光までに必要な時間を短縮することを実現し、気化熱を用いた冷却システムを装置に組み込むことで組織標本の温度上昇はほぼ完全に抑制できることがわかり、蛍光消光装置TiYO™が完成しました(特許出願済み)。
1) Tsuneoka et al. 2022 Front Mol Neurosci.
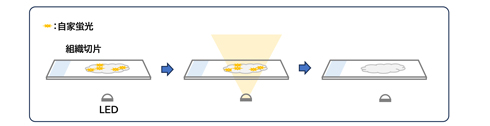
※消光のイメージ図
利点① 染色シグナルに影響を与えず、自家蛍光を消光
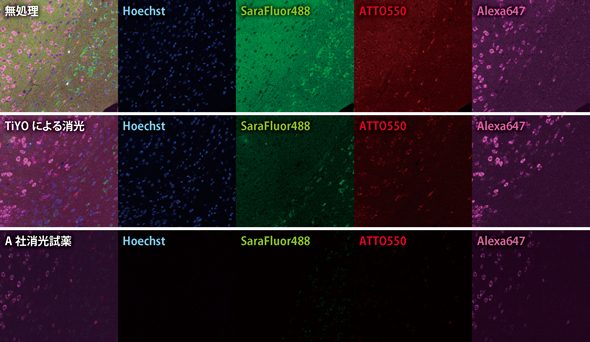
蛍光染色における TiYO™の効果。染色前にTiYO™を使用した例(中段)では、蛍光シグナルにほとんど影響を与えない。染色後の消光試薬処理では、蛍光シグナルが減衰してしまう。
利点② 自家蛍光の強い生物種にも使用可能

シロサケのエラ組織切片上での自家蛍光の例と TiYO™による消光処理。全ての画像は撮影およびコントラスト調整を同一の条件で行った(下段は組織の輪郭を白線で示した)。
東邦大学 理学部 生物分子科学科 塚田 岳大先生 提供
利点③ 操作が簡単

製品仕様
| 項目 | 仕様 |
| 付属品 | 電源ケーブル |
| 使用環境 | 0 ~ +40°C、20 ~ 85%RH(結露無し) |
| 電源 | AC100 ~ 240V、50/60Hz |
| 消費電力 | 最大 310W |
| 寸法(W × D × H) | 291 × 210 × 285mm(凸部含まず) |
| 重量 | 10kg |
| 処理可能サンプル数 | スライドガラス:最大 12 枚(重ねて消光する場合) |
FAQ(クリックすると回答が出ます。)
▶染色前と染色後どちらで使用しますか?
染色前の前処理として行ってください。
▶そのままTiYOにセットするだけですか?
自家蛍光が弱めなサンプルはそのままセットするだけでも消光効果が得られますが、3%過酸化水素/メタノールで室温で10分間反応後、PBSで5分間洗浄してからセットして頂くと十分な消光効果が得られる為、前処理として推奨しております。
▶GFPやmCherryが発現しているサンプルでも使えますか?
自家蛍光だけでなくGFP等の蛍光色素も消光してしまいます。GFPやmCherryが発現しているサンプルで使用したい場合は、手間にはなりますが消光後にGFPやmCherryを抗体染色で検出することは可能だと思います。
▶賦活化処理する場合はどのタイミングで使用したら良いですか?
これまでの検討で切片を熱処理すると自家蛍光が増強する事が分かっています。加熱による賦活化処理をする場合は、賦活化処理後にご使用ください。ProK等の酵素による賦活化処理では自家蛍光は増強しませんので、この場合は前後どちらでも構いません。
▶ISHpalette™と併用する場合はどうしたら良いですか?
ISHpalette™との併用の場合は最初の「
関連製品
TiYO-TRAY:スライドガラス用トレイ

TiYO-AD-WM:ホールマウント用アダプター

品番情報
| 品番 | 商品名 | 数量単位 |
| TiYO | 自家蛍光消光装置 TiYO | 1台 |
※ 掲載商品の仕様及び外観は、予告なく変更される場合がありますので、ご了承願います。