筋肉・皮膚・関節・軟骨・腫瘍・その他へのエレクトロポレーションによる遺伝子導入
アプリケーション
in vivoエレクトロポレーション法によるマウス筋肉へのCRISPR/Cas9導入
eGFP KOマウスを用いたCRISPR遺伝子修復評価系の確立
図1:eGFP KOマウス筋肉におけるeGFP遺伝子修復
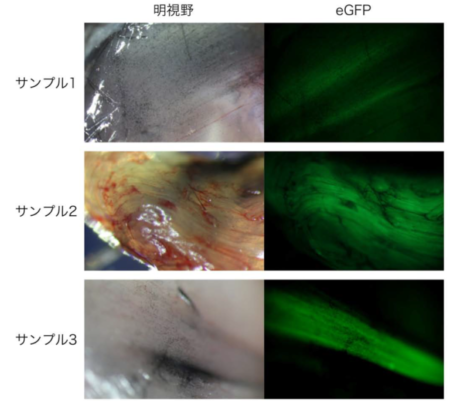
eGFP遺伝子修復を試みたeGFP KOマウス筋肉におけるeGFP蛍光。サンプル1~3は独立した個体である。
筋肉におけるin vivo遺伝子修復評価系の確立を行うにあたり、まずは野生型マウスにeGFP発現プラスミドを導入する系を用いて遺伝子導入条件の検討を行った。
その結果、ヒアルロニダーゼの投与30分後に核酸溶液(100 µl)をCUY568-4-0.5筋肉用注射針4本型電極(ネッパジーン社)により表皮から1.5~3.5 mmの深さで注入し、エレクトロポレーター NEPA21(ネッパジーン社)でエレクトロポレーションを行うことで比較的再現性良く筋肉でeGFP蛍光を確認できることが分かった。
そこで次に、eGFP KOマウスの筋肉にCRISPR/Cas9関連核酸を直接導入することで、筋肉においてeGFP遺伝子が修復されるかを検討した。
その結果、個体間で蛍光の確認できた範囲にばらつきがあるものの、全ての個体の筋肉において緑蛍光を確認することができた。(図1)
東海大学 医学部 基礎医学系 分子生命科学 三浦浩美先生 提供
※上原記念生命科学財団研究報告集, Volume 31, 2017年 参考
エレクトロポレーション法による筋肉への遺伝子導入
1)パルス発生装置ならびに電極
電気パルスは、パルス発生装置 NEPA21 ・ CUY21SC ・ CUY21EDIT(ネッパジーン社)を用いて発生させた。
電極は電極幅が3mmあるいは5mmに固定された、直径0.4mm (27G相当) の平行な2本のステンレス針からなる針型電極を用いた。
2)プロトコル
- マウスに0.01ml/gの割で、6mg/mlのペントバルビタールナトリウム液を腹腔内投与し、麻酔する。
- 生理食塩水に溶解した発現プラスミド50μg(濃度1.5μg/ml)をインスリンシリンジ(27ゲージ針)に移す。
- このDNAをマウスの下腿部筋肉(前脛骨筋)に筋注する。
- その後直ちに、DNA筋注部位を挟むように、5mm間隔の一対の針電極(27ゲージ)を筋肉内に挿入し、50msの電気パルスを1パルス/秒の割り合いで3パルス、さらに逆方向に3パルス与える。
- プラスミド発現の範囲を調べるために、pCAGGS-lacZを導入したマウスについて、導入5日後の組織切片をX-galで染色する。
注)マウスの前脛骨筋は小さいので、注射できる容量は50μlまでである。
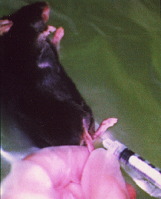
筋肉内へのDNA注射
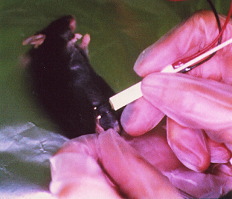
In Vivoエレクトロポレーション
3)X-gal染色
発現の範囲を調べるために、βガラクトシダーゼ発現プラスミドpCAGGS-lacZを同様の方法で筋肉に導入した。 筋注の2日後に、前脛骨筋を摘出し、ドライアイスアセトンでOCTコンパウンドに包埋した後、クリオスタットで15μmの切片を作製し、APS*でコートしたスライドグラスにはりつけた。 これを1.5%のグルタールアルデヒドで室温、10分固定した後、PBSで3回洗浄した。 そして、1mMのX-galを37℃、3時間反応させた後に再び洗浄し、エオジンで対比染色を行った。 その結果、多くの筋線維で発現していることが示された。 エレクトロポレーションなしでは、ほとんど染色される細胞は認められなかった。

筋肉全体 (エレクトロポレーション後)
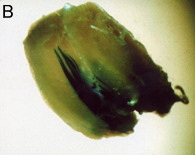
筋肉全体 (エレクトロポレーションなし)
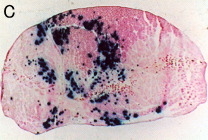
凍結切片 (エレクトロポレーション後)
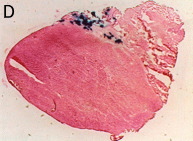
凍結切片 (エレクトロポレーションなし)
大阪大学大学院医学系研究科 幹細胞制御分野 宮崎純一先生 提供
※Nature Biotechnology, Volume 16, Number 9, Pages 867-870, September 1998 参考
エレクトロポレーション法による成体マウス皮膚への遺伝子導入


1:Sピンセットフォーク3針 & 長方形電極 5mm×10mm(CUY663-5X10)
2:スクエアー式遺伝子導入装置 CUY21EDIT
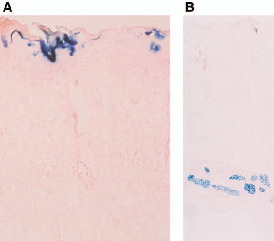
図A:上皮細胞(角質・顆粒・有棘細胞)での発現 エレクトロポレーション(電圧18V)後、1日目 倍率:×250
図B:皮下筋層での発現 エレクトロポレーション(電圧18V)後、7日目 倍率:×70
新潟大学大学院医歯学総合研究科 生体機能調節医学専攻内部 腎・膠原病内科学分野 丸山弘樹先生 提供
※Epidermal Cells Methods and Protocols, Series: Methods in Molecular Biology, Volume 289, Pages 431-436, October 2004 参考
文献
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産