抗がん剤併用時の細胞毒性評価
抗がん剤併用時の細胞毒性評価
アプリケーション
CASYを用いた新規ポリケモセラピー療法の化学感受性アッセイ
はじめに
CASYは、正確な細胞計数のほか、細胞の生存率や細胞毒性測定にも広く利用されています。その利点は、細胞をわずか数秒で、シンプルかつラベルフリーで測定できることと、優れた精度での測定と統計学的な関連性のあるデータです。
最近の研究では、化学療法における抗がん剤の組み合わせの細胞毒性を評価するためにCASYが採用されました。その目的は、より広い治療域を持つ新しいポリケモセラピー療法を設計することです。
アプリケーション
Weinreich et al.による最近の研究(1)では、胃がんに対する標準的な3剤併用療法(ECF)と新しい2剤併用(D-D)ポリケモセラピーで治療した胃腺がん細胞株と非悪性腫瘍細胞株について検討されました。薬剤の組み合わせによる効果は、CASYを用いた成長阻害アッセイで評価しました。
希釈した細胞懸濁液400μLを3回測定しました。薬剤の細胞毒性効果は、実験開始時の生細胞数と、様々な組み合わせの薬剤を添加し、5、10、14日間インキュベートした後の細胞数の割合として算出しました。
CASYの評価設定は生細胞のみを含み、死細胞を除外するようにしました。
結果(新規薬剤の組み合わせ効果の評価)
CASY解析により、複合薬剤の種類と量に対する細胞株の特異的な化学感受性をモニタリングすることが可能となりました。
新規二剤併用薬剤(D-D、標準的なECF併用療法の5-FUの代替)は、悪性胃腺癌細胞株に対して非悪性細胞株よりも有効であることが示されました。
結論
CASYでの細胞計数および細胞毒性試験により、本新規EC D-D抗がん剤療法は、胃腺がんに対する標準的な3剤併用療法に代わる有望な方法であることが実証されました。
CASYでの解析により、様々な薬剤の組み合わせに対する胃癌細胞株と非癌細胞株の感受性が異なることが明らかになり、薬剤混合物の抗がん作用を評価することが可能となりました。
ユーザーの声
 Dr. J. Weinreich, Experimentelle Onkologie, Universitätsklinikum Tübingen, Germany
Dr. J. Weinreich, Experimentelle Onkologie, Universitätsklinikum Tübingen, Germany
「CASYを用いた細胞毒性測定により、抗がん剤療法とそれに対するがん細胞株の化学感受性を迅速、簡便、確実に評価することが可能になりました。
CASYの大きな利点は、細胞株ごとに特化したシンプルな測定条件により、破片や死細胞をマスキングし、生細胞およびその凝集体のみを測定できる点です。細胞の状態を完全に記録しているため、死細胞やデブリのデータもいつでも確認できます。」
測定結果
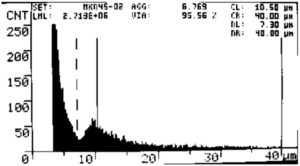
図1.MKN45 の細胞数測定結果。
実験開始時(0日目)に測定。
生存率:95.6% 生細胞数:2.7 X 10^6 cells/mL
LML:生細胞/mL
VIA:生存率
AGG:細胞凝集
CL. CR:生細胞の評価レンジ
NL, NR:死細胞の評価レンジ
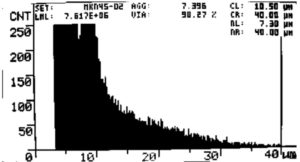
図2. MKN45 細胞数測定結果。
PBSを添加し培養開始後7日目に測定したコントロール区。
生存率:90.3% 生細胞数:7.6 x 10^6 cells/mL
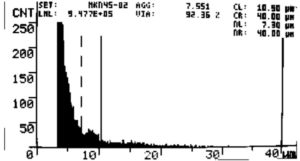
図3. MKN45 細胞数測定結果。
0.86 μmol/L D-Dを添加し培養開始後7日目に測定。
生存率:92.4% 生細胞数:9.5 x 10^5 cells/mL
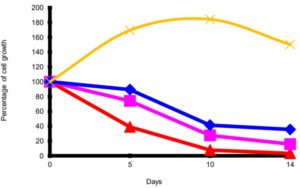
図4.EC D-D 添加後のMKN-45 細胞増殖グラフ。
赤: E= 0,37; C=0,45; D-D=0,41 µmol/L
ピンク: E= 0,15; C=0,18; D-D=0,16 µmol/L
青: E= 0,075; C=0,09; D-D=0,082 µmol/L
黄色:PBS添加のコントロール
引用情報
- Weinreich J, Archid R, Bajaeifer K, Hack A, Königsrainer A, Schott TC.
Growth and Chemosensitivity of Gastric Adenocarcinoma and Non-Malignant Cell Lines in
Response to Novel Anti-Cancer Drug Combinations. Chemotherapy. 2014; 60(5-6):346-352.
DOI: 10.1159/000438943. Epub 2015 Aug 29.
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産