大腸菌・バクテリアへのエレクトロポレーションによる遺伝子導入
アプリケーション
多段階方式エレクトロポレーション法による大腸菌への高効率遺伝子導入
大腸菌(グラム陰性菌)懸濁液に対して、ELEPO21を用いた多段階エレクトロポレーション法と従来エレクトロポレーション法(エクスポネンシャル方式、パルス1回)による遺伝子導入の比較試験を行った。大腸菌(DH5α)のEP用コンピテントセルの調製は対数増殖期の細胞を集菌し常法により行った。当該EP用コンピテントセル(1サンプルあたり菌数109~1011 10%グリセロール溶液)、pUC19ベクター(1サンプルあたり10pg)を混合し、当該混合液20μlを1mm gapキュベット電極(EC-001 ネッパジーン社製)内に注入した。なお、当該一連の操作は、氷上にて冷却しながら行った。大腸菌及びDNA混合液を注入したキュベット電極をELEPO21に接続したキュベット電極用チャンバーに挿入し、下記の電気パルス条件にて3段階方式のエレクトロポレーション処理を行った。
ELEPO21 電気条件
- Poring Pulse(電圧:2,000V, パルス幅:2.5msec, パルス間隔:50ms, 回数:1回, 極性:+)
- Transfer Pulse(電圧:150V, パルス幅:50msec, パルス間隔:50ms, 回数:5回, 極性:+/-)
一方、比較実験として、エクスポネンシャル出力でのエレクトロポレーター装置(ECM630, BTX社製)を用いたこと以外は同様に操作し、下記の電気パルス条件でのエレクトロポレーション処理(高電圧エクスポネンシャルパルス)を行った。
ECM630 電気条件
- 電圧:2,000V, Resistance:200Ω, Capacitance:25μF
その後、アンピシリン含有LB寒天培地上にプレーティングし、pUC19DNAの導入により薬剤耐性を獲得して生育したコロニー数をカウントした。プラスミド1μgあたりのコロニー数を算出し、遺伝子導入効率(cfu/μg)として評価した。
実験結果

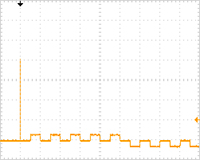
大腸菌の懸濁液 (サンプル抵抗値:約7.7KΩ) に対して、多段階方式エレクトロポレーター装置 (ELEPO21) を用いて電気パルス処理を行うことによって、極めて高い遺伝子導入効率が実現できることが示された。従来のエクスポネンシャル出力でのエレクトロポレーター装置 (ECM630) を用いて高電圧パルス処理を行った場合よりも、約4.9倍も高い遺伝子導入効率が達成できることが示された。
※当該遺伝子導入実験は2反復で行い、平均値を算出した。
※ELEPO21とECM630の電気条件は、事前に検討した最適条件を使用。
文献
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo・Ex Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo・Ex Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産