細胞バリア機能
上皮細胞や内皮細胞は、その層を横切る分子の通過を制御しています。病気、特に血管疾患はこの機能が損なわれたときに起こるので、この特性をin vitroで測定することがしばしば求められます。ECIS®技術により、このような研究に理想的な高感度リアルタイム連続バリア抵抗が可能となります。
アプリケーション
細胞モノレイヤーのバリア機能モニタリング
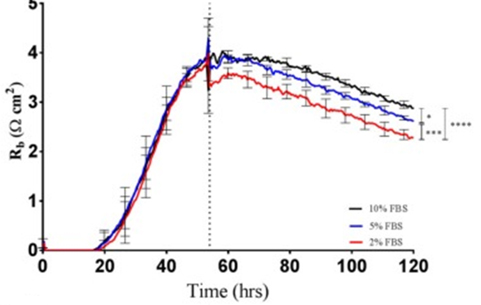
生体内では、上皮細胞や内皮細胞のモノレイヤーがバリアーとなっています。これらの細胞レイヤーは、異なる組織間や間質区画間における分子の自由な移動を制御する重要な役割を担っています。多くの疾患や炎症において、これらのバリアは損なわれているため、その透過性を測定することは、細胞生物学者や一般的な医療関係者にとって大きな関心事です。
ほとんどの種類の上皮細胞や内皮細胞はin vitroで培養してモノレイヤーを形成することができ、このコンフルエントな細胞レイヤーがもたらすバリア機能を測定することが可能です。さらに、適切なツールを用いれば、化合物への曝露、シェアストレスなどの物理的変化により細胞環境が変化した際の、細胞層の動的変化を追跡することも可能です。
バリア機能の測定
ECIS®装置を用いて、細胞モノレイヤーのバリア機能(またはその逆である透過性)を電気的にリアルタイムでモニタリングするための、さまざまなアプローチを提供しています。どのアプローチを用いるかは、細胞のバリア機能の程度、必要なスループット(実験条件の数)、特殊な実験条件、そしてもちろん、研究者の好みによります。もう一つの主な検討事項は、電極上で増殖した細胞をモニターしたいのか、メンブレンフィルター上で増殖した細胞をモニターしたいのか、ということです(TEERアプリケーションを参照)。
電極上の細胞バリア機能モニタリング
- ECIS® Z-theta装置と最新のソフトウェアパッケージを使用
- ゴールド基板を用いた16または96ウェルの標準ECIS®電極で細胞を培養
- 培養条件下で連続的かつリアルタイムに測定を実施
- 使いやすいソフトウェアにより、インピーダンスデータをTEER値(Ω・cm2)に変換することが可能
金製フィルム電極を用いたバリア機能の測定
まず、ECISの定電流測定で使用されるAC周波数の重要性について考えてみましょう。下図はコンフルエントな細胞層の断面図における、電流の経路を矢印で示したものです。赤い矢印は、電極界面から流れてきたイオン電流が、電極と基底細胞膜の間の溶液空間を移動し、細胞間の傍細胞通路(バリア機能)を通過していく様子を表しています。一方、緑の矢印は、ECISが交流測定でるために可能となる電流の経路と、電流が細胞膜を通して容量的に結合できることを表しています。
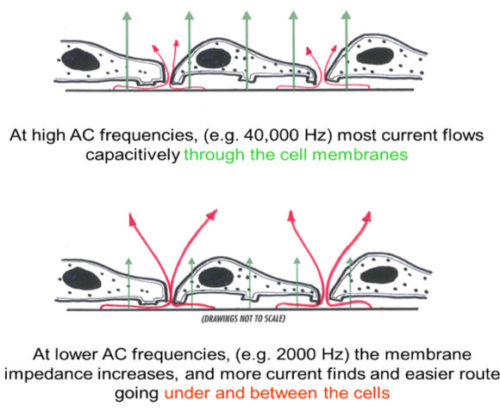
電流は常に抵抗が最小である経路をたどります。高い交流周波数(40,000 Hz)では、膜のインピーダンス(容量性リアクタンス)は比較的小さく、電流は主に絶縁性の細胞膜を容量結合し、傍細胞路を通過する電流はほとんどありません。一方、交流周波数が低い場合(例では2,000Hz)、膜のインピーダンスが高くなり、電流のほとんどが細胞の下や細胞間の狭い空間(溶液路)を流れるようになります。
この違いの結果、高周波数インピーダンスは細胞の広がりとコンフルエント層の確立をモニターするのに使用でき、低周波数インピーダンスは細胞についての溶液経路、つまり細胞レイヤーのバリア形成をモニターするのに使用できるのです。
様々なAC周波数帯における測定データ
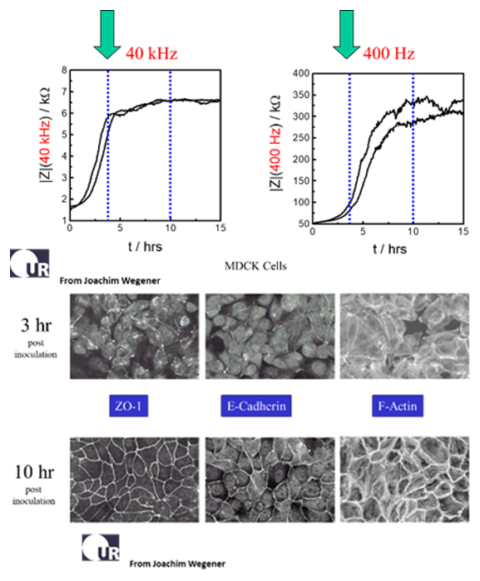
左のデータは、MDCK II 細胞(イヌ腎臓上皮細胞)を接種した後の、同条件の2つのウェルにおけるインピーダンスの変化を示したものです。顕微鏡写真によると、接種後約3時間で細胞レイヤーが形成されコンフルエントになったことが、40,000 Hzでのインピーダンスのプラトーによって示されています。同じウェルを400Hzで測定すると、バリア機能の形成が完了するのは接種後約10時間後であることがわかります。このことは、接合タンパク質であるE-カドヘリンとZO-1(zona occludens protein)の染色を用い、顕微鏡で確認できます(データ提供:レーゲンスブルク大学、Joachim Wegener教授)。タイトな上皮細胞では、低交流周波数でのインピーダンスにより、細胞レイヤーのバリア機能を極めて効果的に測定できます。
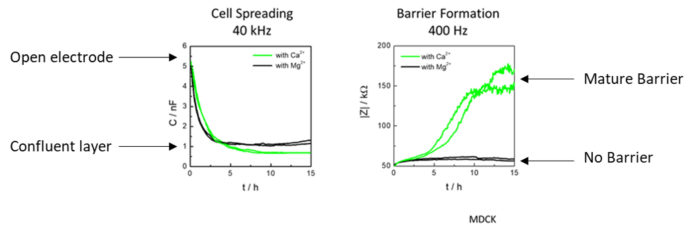
上図は、Ca2+またはMg2+の2価イオンのみを含む平衡塩溶液に、時間ゼロで植え付けたMDCK細胞です。細胞増殖は高周波数(40KHz)のキャパシタンスで、バリア形成は低周波数(400Hz)のインピーダンスで測定されました。グラフが示すように、Ca+2 と Mg+2 はともに細胞増殖を起こすが、同じウェルに Ca2+ だけを入れ、Mg+2 を入れない場合、バリアーが形成されることがわかりました。
ECIS®測定モデル
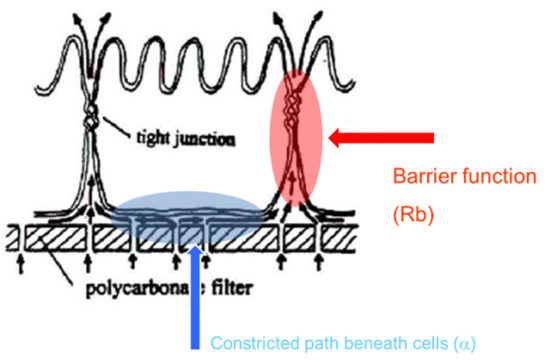
この図は、隣接する細胞とタイトジャンクションが形成されている上皮細胞の断面を示しています。この例では、多孔質フィルターを細胞基質として示していますが、ECIS金電極基板上に細胞を播種することも同様に可能です。どちらの場合でも、細胞の下には狭い空間があり(青で囲った部分)、そこを通らないとほとんどの電流(またはトレーサー)は細胞間隙(目的の細胞バリア、赤で囲った部分)を通れません。
多くの上皮細胞レイヤーでは、この細胞下通路の影響は狭い細胞外通路に比べて小さく、バリア機能の測定に大きな役割を果たすことはありません。しかし、バリア機能が弱い細胞(例えば、いくつかの内皮層)では、傍細胞路をきれいに測定することが困難になる可能性があります。
幸い、ECISソフトウェア(Giaever and Keese)を使用することで、この2つの側面を分離して測定することが可能です。この機能により、バリア機能(Rb)と細胞下通路(α)の両方の時間経過変化を独立して表示することができます。このモデリングソフトウェアは、ECIS® Z-Thetaに標準装備されています。
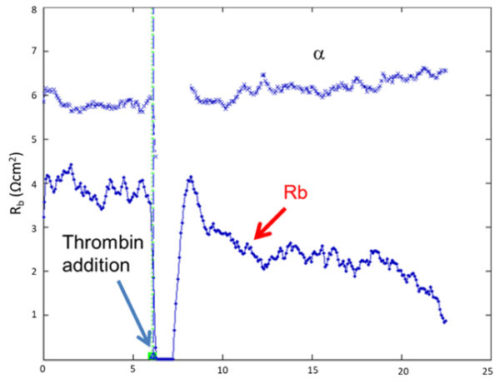
これはトロンビンに曝された微小血管内皮細胞におけるRbの経時変化を、ECIS®ソフトウェアによってモデル化した例です 。αの値は測定中、基本的に一定であり、比較のためにプロットされています。
内皮細胞のバリア機能
内皮細胞では、タイトジャンクションを持つ上皮細胞に比べ、バリア機能は相対的に低く、バリア機能の変化を評価するために、4,000 Hzで測定したECISインピーダンスの抵抗部分が一般的に使用されています。このアッセイは1992年に紹介され(Tiruppathi et.al)、ECIS電極上に増殖した内皮細胞の複合インピーダンス測定値を用いて、インピーダンスの抵抗部分のみを報告しています。この最初の研究では、トロンビンに曝されたウシ肺微小血管内皮細胞の応答が評価されました(下図参照)。
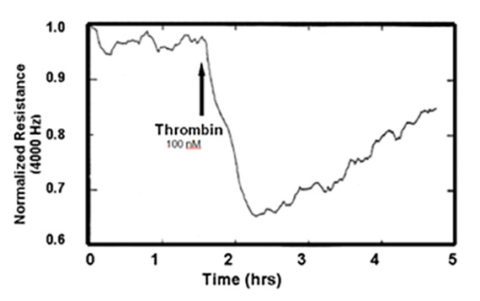
この最初の研究以来、4,000Hzでのインピーダンスの抵抗部分は、多くの研究室で内皮透過性のリアルタイムの変化をモニターするために使用されており、このアッセイは多くの論文に掲載されています。ECISは、本アッセイにおけるUsing チャンバーや他のメンブレンフィルター測定に代わる魅力的な方法として、ますます注目されるようになってきています。最小限の労力でバリア機能データを収集できる利便性に加え、この測定にはタグ付き化合物や関連するサンプリング/測定技術が不要であることもその理由です。
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ メカノポレーション
- 細胞治療
- 薬剤スクリーニング
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 皮膚
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
■ マイクロピック&プレースシステム
- 動物細胞
- 植物細胞
- タンパク結晶
- 微量塗布
- ドロップレット
- 1細胞・微粒子のピッキング
■ UnipicK・UnipicK+・A-picK
- 培養細胞
- マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
- 作物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ バイタルサインモニタリング
- MARTA-Padバイタルサインの測定
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産