電気式細胞融合によるハイブリドーマの作製
アプリケーション
モノクローナル抗体作製における腸骨リンパ節細胞を用いたポリエチレングリコール融合法(PEG法)、電気的融合法、センダイウィルス外膜蛋白質融合法(HVJ-E法)との比較検討
◆電気的融合法
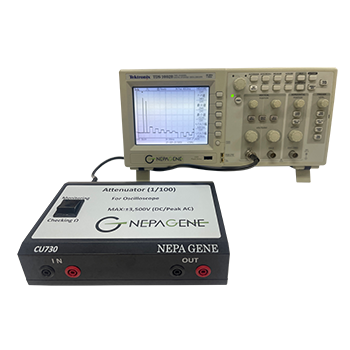
電気的融合法は、細胞融合装置 ECFG21・LF201(ネッパジーン社製)を用いて行った。電極は、MSスタンド型チャンバー白金電極 CUY497P2(電極間隔:2mm gap, 電極サイズ:L80mm×W2mm×H5mm, 容量:0.8ml, ネッパジーン社製)を用いた(図1)。電気融合用電極液は、0.3Mマンニトール、0.1mM塩化カルシウム、0.1mM塩化マグネシウム溶液を使用した。

- 15ml用プラスチック製遠沈管にリンパ球とミエローマが1:1の割合になるように融合用電極液に懸濁し、遠心して上清を吸引除去した。 細胞沈査に融合用電極液を2.4ml加えて細胞懸濁液を作った。
- 細胞懸濁液を0.8mlずつ3回に分けて電気パルスをかけた。 細胞を接着(パールチェーンを形成)させる為の交流(周波数:1MHz、電圧:30V)を20秒間行い、細胞融合する為の直流パルス(電圧:350V、パルス幅:30μs、パルス間隔:0.5秒)を3回かけた。
- 融合し終えた細胞液は、1000回転5分間の遠心後、細胞沈査に10%BM-Condimed H1を添加したHAT培地を加えて攪拌し、96穴培養プレート4枚に播いた。
◆PEG法と電気的融合法の比較
マウス腸骨リンパ節細胞を用いてPEG法と電気的融合法の比較実験を行った。 2本の凍結チューブの細胞を解凍して混ぜ合わせ(約4×107個)、それを2等分し一方をPEG法で融合し、もう一方を電気的融合法で融合した。 このセットを3組行った。 3セットの融合の比較では、1.5~4.0倍の値で電気的融合法の方が多くの陽性ウェルが得られた(表1)。 平均すると2.8倍であった。
表1:マウス腸骨リンパ節法における融合法の比較
PEG法 陽性ウェル数 | 電気的融合法 陽性ウェル数 | PEG法:電気的融合法 比率 | |
| 1回目 | 166 | 250 | 1:1.5 |
| 2回目 | 60 | 182 | 1:3.0 |
| 3回目 | 65 | 262 | 1:4.0 |
◆電気的融合法の考察
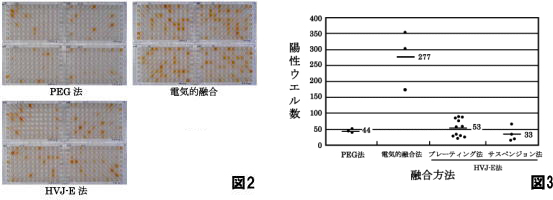
ラット腸骨リンパ節細胞を用いて、PEG法・電気的融合法・HVJ-E法の3種類の融合法で比較実験を行った(図2・図3)。 電気的融合法は、PEG法やHVJ-E法に比べて少量のリンパ球でも細胞融合ができ、また操作時間も短時間ですむ。 融合した細胞に与えるダメージが少ないようでハイブリドーマの成長が早い。 従って陽性ウェルのELISAスクリーニングもPEG法に比べて1日早く行うことになった。 融合の操作が簡単なため融合技術に個人差はないと考えられる。 一度、細胞融合操作及び電圧の条件等を最適化しておけば同じ動物種のリンパ球であれば、いつも同じ条件で細胞融合が行える。 一定条件で融合させれば結果にばらつきが少ない。 細胞融合も短時間で細胞に与えるダメージも少なくしかも融合効率が一番高い。 今回のラットリンパ節法のモデル実験では、PEG法に比べて約6倍の陽性ウェルが得られている。
◆まとめ
今回、3種類の細胞融合方法をマウス及びラット腸骨リンパ節細胞を用いて比較検討した。 PEG法は、経済的であるが融合ごとの差が大きい。 HVJ-E法の効率は、PEG法と同程度かそれ以上であったが融合細胞が元気に増殖すると言う点においてPEG法に比べて優れていると思われる。 電気的融合法の効率は、PEG法と比較してラットで約6倍、マウスで約3倍の高い効率であった。 効率・確実性と言う点も含め3種類の細胞融合方法の中で、明らかに電気的融合法が優れていると判断される。
重井医学研究所 免疫部門 井上聡子先生・佐渡義一先生 ご提供
ECFG21とPEG法の細胞融合効率の比較 - 低分子抗原またはペプチド抗原 -
以下の抗原1・抗原2・抗原3は、低分子もしくはペプチドで、抗原特異的な抗体を産生する融合細胞を得るのが非常に難しい。それぞれの抗原について、リンパ球をミエローマ細胞に融合させるにあたって、ECFG21電気融合法とPEG法とを比較した。結果は、ECFG21の方が、PEG法よりも25-100倍と圧倒的に細胞融合効率が高かった。PEG法では殆ど抗体産生クローンが得られないような場合でも、ECFG21を用いればクローンを得ることができる。
Fusion/M: リンパ球1 x 10^6個辺りのハイブリドーマの数
Positive clone/M: リンパ球1 x 10^6個辺りの抗原特異的モノクローナル抗体産生クローン数
ECFG21 w/CUY497P2: ECFG21とCUY497P2電極(0.8 ml)、ECFG21 w/CUY497P8X10: ECFG21とCUY497P8X10電極(大容量 6.4 ml)
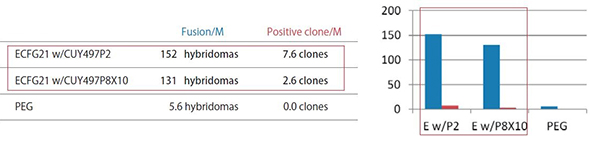
抗原1:
20 kDa immunosuppressive protein with high homolog
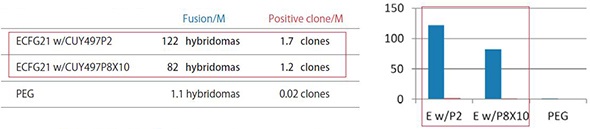
抗原2:
Hydrophobic octapeptide
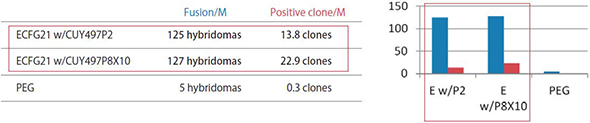
抗原3:
Highly hydrophobic 17 amino acid peptide
文献
- モノクロナール抗体
- 脾臓
- リンパ球
- マウス骨髄腫細胞
Development of a monoclonal antibody to study MARCH6, an E3 ligase that regulates proteins that control lipid homeostasis
Xu S, Donnelly L, Kober DL, Mak M, Radhakrishnan A.
J Lipid Res. 2024 Sep 19:100650.
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo マウス・ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- Ex Utero培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・胃・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・前立腺・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- 脂質ナノ粒子 (LNPs) のスケールアップ
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
- 造血幹細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
■ 蛍光組織染色
- 自家蛍光消光
■ in situ HCR
- 標的mRNAの蛍光検出
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物計数カウント
- 真菌・酵母など
- 細菌
■ 微生物向けライブセルイメージング・解析
- 薬剤感受性試験
- 食品微生物学
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In Vivo イメージング・モニタリング
■ 小動物用超音波イメージング
- 心血管研究
- 腫瘍・がん研究
- 汎用アプリケーション
- 発生生物学
- HIFU研究
- イメージガイドソノポレーション
- 弾性イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産