脳・脳切片・培養脳組織へのエレクトロポレーションによる遺伝子導入
アプリケーション
エレクトロポレーション法による成体ラット脳への遺伝子導入
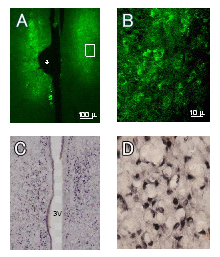
図A:10週齢雌ラットの (左右) 内側視索前核へのエレクトロポレーション4日後のGFP発現蛍光画像 (*印は電極の一部が存在した位置を示す。)
図B:図Aの強拡大画像(対物60×レンズ)。GFPシグナルは主として細胞体の核周囲部に認められる。
図C:免疫染色により内側視索前核ならびに視索前野室周囲核に存在するエストロゲンα受容体を染色。3Vは第三脳室
図D:Cの強拡大画像 (対物60×レンズ) 。エストロゲンα受容体シグナルは主に細胞核に認められる。
北海道大学病院 高次口腔医療センター 白川哲夫先生 提供
エレクトロポレーション法による海馬組織切片への遺伝子導入
1)エレクトロポレーションのセットアップ略図
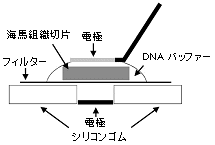
マウス胎児の海馬切片をミリポアフィルター上に置き、DNAバッファー5μl(DNA濃度:1μg/μl)を海馬切片の上から滴下します。
ニードル白金電極(CUY611P3-1)をDNAバッファー表面に接触させます。
エレクトロポレーション後、海馬切片を冷たいHBSS溶液の入ったシャーレに戻します。
2)培養ラット胚脊髄神経管への蛍光タンパク質遺伝子の導入
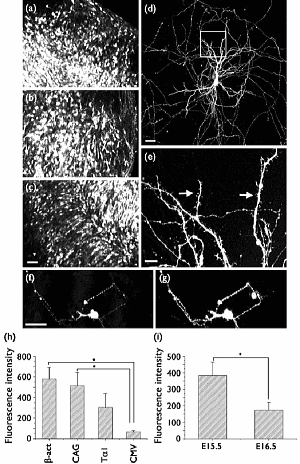
図(a~c) エレクトロポレーション後3日目の器官培養した海馬組織切片のeGFP発現(使用したプロモーター a:CAG, b:Tα1, c:β-actin)
図(d, e) 成長した海馬ニューロンは、エレクトロポレーション後培養され14日間に渡りeGFP発現(β-actin)が維持されました。
図(d)の四角領域を拡大したものが図(e)で、樹状突起の矢印部分に樹状突起スパインが見られます。
図(f, g) Tα1X4-eGFPとTα1X4-mRFP1を1対1の割合で混合して、エレクトロポレーション後7日目の海馬ニューロン。単一細胞の中で、eGFP蛍光(f)とmRFP1蛍光(g)の両方を観察することができます。
図(h) 4つの異なったプロモーター配列(β-actin, CAG, Tα1, CMV)を有するeGFP発現プラスミドにおけるエレクトロポレーション後の海馬組織切片の蛍光強度の比較。組織切片は4日間培養後に固定され、共焦点顕微鏡を使用し蛍光強度を測定しました。(単位領域ごとに)
図(i) 2つの異なる発育ステージ(E15.5, E16.5)におけるエレクトロポレーション後の海馬組織切片の蛍光強度の比較。組織切片は4日間培養後に固定され、共焦点顕微鏡を使用し蛍光強度を測定しました。
図(a~d, f, g)スケールバー:50μm、図(e)スケールバー:10μm
東京大学 大学院医学系研究科・医学部 神経細胞生物学 岡部繁男先生 提供
※Neuroreport, Volume 15, Issue 6, Pages 971-975, April 29, 2004 参考
文献
エレクトロポレーション
■ 培養細胞
- 初代培養細胞
- iPS細胞・ES細胞・幹細胞
- オルガノイド
- 株化細胞
- 培養細胞(NEPA Porator)
- 付着状態の細胞
■ In Vivo・Ex Vivo マウス/ラット
- 受精卵(TAKE法)
- 受精卵(i-GONAD/r-GONAD法)
- In Utero胎児
- 培養胚
- 脳・脳切片・培養脳組織
- 網膜・角膜・脊髄・坐骨神経
- 肺・脾臓・肝臓・腎臓・腸
- 膵臓・ランゲルハンス島
- 精巣・卵巣・生殖腺・子宮
- 筋肉・皮膚・関節・軟骨・腫瘍・その他
■ In Vivo その他の動物
- ウシ・ブタ・その他の動物の受精卵
- ハムスターi-GONAD法
- サル皮膚
- ニワトリ(In Ovo・その他)
- ゼブラフィッシュ・その他の魚
- 昆虫・その他
■ 植物細胞・藻類
- 植物細胞
- 藻類
■ エクソソーム
- エクソソーム
■ バクテリア・酵母・菌類
- 大腸菌・バクテリア(細菌)
- 酵母・菌類
- 大腸菌・バクテリア・酵母・菌類(NEPA Porator)
ドラッグデリバリー・遺伝子導入
■ ナノ粒子作製
- 概要
- 脂質ナノ粒子(LNPs)
- リポソーム
- ポリマーナノ粒子
- T細胞への遺伝子導入
■ 超音波(ソノポレーション・FUS)
- 遺伝子導入の概要
- 脳
- 肝臓・皮膚・その他
- 心臓
- 培養細胞
- 肺
- 筋肉
■ ジェットインジェクション
- マウス・ラットの皮膚
■ パーティクルデリバリー
- 植物
- 動物
■ マイクロインジェクション
- 植物細胞
電気式細胞融合
■ ハイブリドーマ作製
- モノクローナル抗体産生など
■ 卵子活性化
- 顕微授精(ICSI)の前・後の電気刺激など
■ 体細胞核移植
- クローン動物の作製
■ 四倍体胚の作出
- テトラプロイドキメラの作製など
■ その他
- リポソーム・プロトプラスト・酵母など
蛍光組織染色・in situ HCR
■ 蛍光組織染色
- 蛍光組織染色
■ in situ HCR
- Hybridization Chain Reaction
細胞分離
■ 幹細胞分取
- 幹細胞の分取・回収
- VIVANT-CELL®-Pot
1細胞回収・マイクロダイセクション
細胞凍結
細胞・微生物培養 (解析/計数/伸展/灌流)
■ 微生物ライブイメージング・解析
- 薬剤感受性試験
■ リアルタイム細胞解析
- 細胞増殖
- 細胞遊走・創傷治癒
- 細胞毒性
- 細胞バリア機能
- 細胞変性(ウイルス学)
■ 細胞計数分析
- 株化細胞
- 幹細胞
- 初代培養細胞
- バクテリア
- 酵母
- 藻類・原虫
- 血液関連細胞
- その他
- 実験例:細胞毒性評価
- 実験例:藻類摂食率測定
■ 細胞伸展培養
- メカノトランスダクション
- 遺伝子発現
- 細胞接着
- 伸展活性化チャネル
- ナノマテリアル
■ 細胞灌流培養
- 加圧培養
- 薬剤応答
- 細胞分化・長期
- 蛍光観察
In vivo 超音波イメージング
卵振動培養
■ 卵子・胚盤胞
- 単為発生卵子および体細胞核移植胚 に由来する胚盤胞の効率的生産